Niels Henrik David Bohr (1885-1962) adalah seorang fisikawan Denmark yang berkontribusi dalam upaya manusia untuk mengerti struktur atom dan teori kuantum. Karya Bohr merupakan pondasi yang sangat mendasar dalam struktur atom dan teori kuantum, oleh karena itu ia diberi hadiah nobel dalam fisika pada tahun 1922. Bohr juga adalah seorang filsuf dan promotor untuk riset ilmiah. [1][2]

Pada tahun 1913, Bohr melakukan pengamatan pada spektrum atom hidrogen. Mengacu pada teori mekanika kuantum milik Planck, Bohr memodifikasi teori atom Rutherford. Dari percobaannya pada atom hidrogen, spektrum garis menunjukkan bahwa elektron hanya beredar pada lintasan-lintasan dengan energi tertentu.
Berdasarkan hal ini, maka terbentuklah teori atom Bohr, poin-poin pentingnya adalah: [3]
- Elektron-elektron dalam atom mengorbit nukleus. (Orbit disini mirip seperti sistem tata surya, namun yang bekerja bukan gaya gravitasi melainkan gaya elektrostatis).
- Elektron-elektron hanya dapat mengorbit secara stabil, tanpa radiasi, pada orbit tertentu (disebut orbit stasioner) pada sebuah set diskrit jarak tertentu dari nukleus. Orbit ini diasosiasikan dengan kulit energi atau tingkat energi. Pada orbit ini, percepatan elektron tidak menghasilkan radiasi dan hilangnya energi. Model atom ini didasarkan pada teori kuantum Planck tentang radiasi.
- Elektron hanya dapat mendapatkan atau kehilangan energi dengan cara melompati orbit yang diperbolehkan, ke orbit yang lain. Perpindahan elektron menyerap energi apabila lompat dari kulit dalam ke kulit luar, sebaliknya membebaskan energi apabila lompat dari kulit luar ke kulit dalam. Elektron menyerap atau memancarkan radiasi elektromagnetik dengan frekuensi \(v\) ditentukan dengan perbedaan tingkat energi sesuai dengan persamaan Planck:
\(\Delta E = E_2 - E_1 = hv\)
\[v = \frac{1}{T}\]
di mana \(h\) adalah konstanta Planck, dan \(T\) adalah periode orbit.
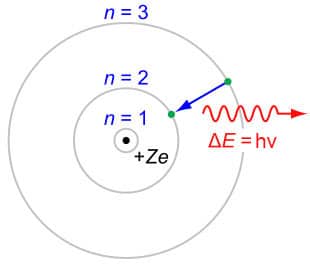
Kulit atom sering disebut dengan \(n\) yang menyatakan tingkatan kulit (jarak kulit) dari nukleus (inti atom).
Meskipun sudah berhasil menjawab pertanyaan mengenai inti atom dan orbit elektron, namun teori atom bohr masih memiliki kekurangan. Kekurangannya antara lain hanya dapat menerangkan atom atau ion yang mengandung satu elektron, model atom ini tidak sesuai dengan atom atau ion yang berelektron banyak. Bohr juga belum mampu menjelaskan bagaimana atom dapat membentuk ikatan kimia menjadi molekul.
Kutip materi pelajaran ini:
Kontributor Tentorku, 2015, https://www.tentorku.com/teori-atom-bohr-tata-surya/ (diakses pada 27 Jul 2024).
Materi pelajaran ini bukan yang Anda butuhkan?
Anda bisa mengirimkan saran pada Tentorku di akun fb/twitter/google kami di @tentorku.
Topik dengan voting komentar terbanyak akan mendapatkan prioritas dibuatkan pembahasan.