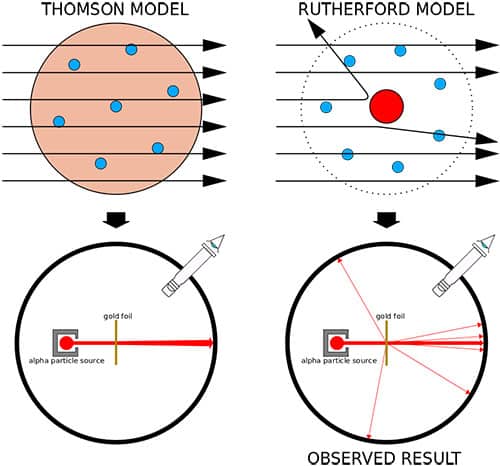
Ernest Rutherford (1871-1937) adalah seorang kelahiran Selandia Baru, seorang fisikawan Inggris, yang dikenal sebagai bapak fisika nuklir. Ia juga salah satu pelaku eksperimen fisika terbaik sepanjang masa. Rutherford berhasil mematahkan model gurunya sendiri, yaitu J. J. Thomson. Pada masa itu, semua orang membayangkan atom berbentuk seperti roti kismis, dan Rutherford ingin membuktikan kebenaran model atom gurunya tersebut. [1]

Melalui percobaan yang dilakukan diantara tahun 1908-1913 oleh kedua muridnya Hans Geiger dan Ernest Marsden, partikel alfa (sinar alfa) ditembakkan pada lembaran lempeng (foil) emas yang tebalnya hanya 1/3000 inci lalu melacak jejak partikel tersebut. Eksperimen ini dikenal dengan Geiger–Marsden experiment atau Rutherford gold foil experiment. Sebagian besar partikel menembus lempeng emas, seperti yang diharapkan pada model roti kismis, namun terdapat sebagian partikel yang memantul seakan-akan menabrak sesuatu yang padat. Kata-kata terkenal dari Rutherford mengenai hal ini adalah "Ini hampir se-luar-biasa seperti ketika kamu menembakkan peluru 15 inci pada selembar kertas tisu, dan peluru itu memantul kembali dan mengenaimu." [2]
"It was almost as incredible as if you fired a 15-inch shell at a piece of tissue paper and it came back and hit you."
Hanya muatan positif dan target yang relatif berat, seperti nukleus yang diusulkan Rutherford, dapat menjelaskan gaya tolak yang begitu besar. Elektron negatif yang menyeimbangkan muatan inti positif dianggap mengelilingi nukleus dengan orbit melingkar. Gaya elektrostatis antar elektron dan nukleus dianggap seperti gaya gravitasi yang tarik-menarik antara matahari dan planet-planet yang mengelilinginya.
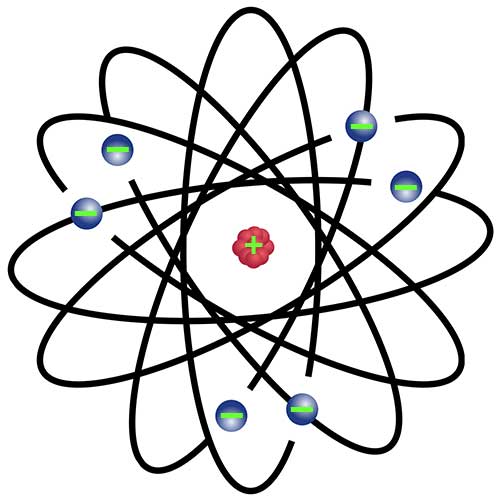
Poin-poin kunci dari Teori Atom Rutherford adalah: [4]
- Awan elektron pada atom tidak mempengaruhi penyebaran partikel alfa.
- Sebagian besar muatan positif atom terkonsentrasi pada volume yang relatif kecil di bagian tengah atom, yang sekarang dikenal dengan nukleus.
- Massa dari atom berat seperti emas terkonsentrasi di bagian tengah (nukleus).
- Atom itu sendiri memiliki diameter 105 kali diameter nukleus.
Kekurangan teori atom ini adalah tidak mampu menjelaskan mengapa atom bisa berada dalam keadaan stabil sebab pada kenyataannya, lintasan elektron negatif akan memancarkan medan elektromagnetik, dimana lama kelamaan lintasannya akan berbentuk spiral dan dapat menyebabkan elektron jatuh kedalam inti atom (nukleus) karena kehabisan energi. Model Atom Rutherford juga tidak menjelaskan susunan elektron-elektron yang mengelilingi nukleus. Model Rutherford sendiri hanya bertahan beberapa tahun karena digantikan oleh murid Thomson yang lain, yaitu Bohr yang mempelopori teori kuantum awal.
Kutip materi pelajaran ini:
Kontributor Tentorku, 2015, https://www.tentorku.com/teori-atom-rutherford-nukleus/ (diakses pada 10 Dec 2023).
Materi pelajaran ini bukan yang Anda butuhkan?
Anda bisa mengirimkan saran pada Tentorku di akun fb/twitter/google kami di @tentorku.
Topik dengan voting komentar terbanyak akan mendapatkan prioritas dibuatkan pembahasan.